Objetivos
OA13 Analizar y calcular las variables de presión y temperatura de un gas según la ley de Gay-Lussac.
OA13 Analizar y calcular las variables de presión y temperatura de un gas según la ley de Gay-Lussac.
La siguiente imagen representa un experimento, en donde se introduce un gas al interior de un frasco en donde se observa la variación de algunos factores. A partir de la imagen reflexione las preguntas a continuación.

1) ¿Cuáles son las variables que cambian el experimento que se muestran en la imagen?
2) ¿Qué factor se mantiene constante en el experimento?
3) ¿Cómo será la velocidad de las partículas de gas del "caso B" en comparación al "caso A"?
4) En comparación al caso "A" ¿Cómo es la presión que se observa en el "caso B"?
5) ¿Qué ocurre con el volumen al aumentar la temperatura?
6) ¿Qué ocurre con la presión al aumentar la temperatura?
La ley experimental de los gases es una ley que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes se refieren a cada una de las variables que son presión, volumen y temperatura absoluta. La ley de Charles establece que el volumen y la temperatura absoluta son directamente proporcionales cuando la presión es constante. La ley de Boyle afirma que presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la presión y la temperatura absoluta, siempre y cuando se encuentre a un volumen constante.
En esta oportunidad nos enfocaremos específicamente en la Ley de Gay-Lussac.

¿Por qué las latas de aerosol deben mantenerse alejadas del calor? Según la teoría cinético-molecular de los gases, ¿Qué ocurre con las partículas de los gases al interior de este envase si aumenta su temperatura? La ley de Gay-Lussac establece la relación que existe entre la temperatura y la presión de un gas a volumen constante. Esta ley señala que, a volumen constante, la temperatura y la presión de un gas son directamente proporcionales, es decir, al elevar la temperatura, aumenta la presión; y al disminuir la temperatura, disminuye la presión. Para comprender de mejor manera esta ley, analicemos el siguiente esquema, en el que se representa cómo varía la presión de un gas, que está dentro de un recipiente de paredes rígidas, en función de la temperatura.
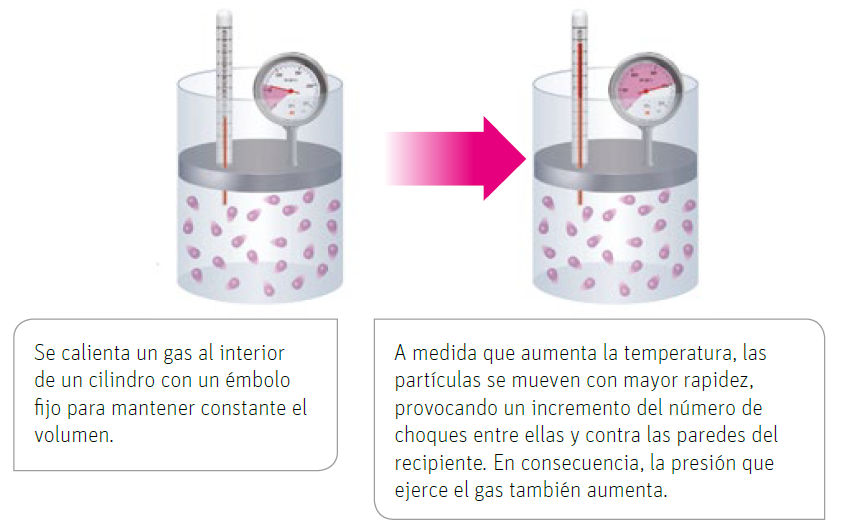
Si se grafica la presión de un gas a volumen constante en función de su temperatura, expresada en escala kelvin, se obtiene una línea recta como la que aparece en el gráfico a continuación. Al dividir la presión por su temperatura respectiva, en cualquier punto del gráfico, el valor que se obtiene es siempre el mismo.
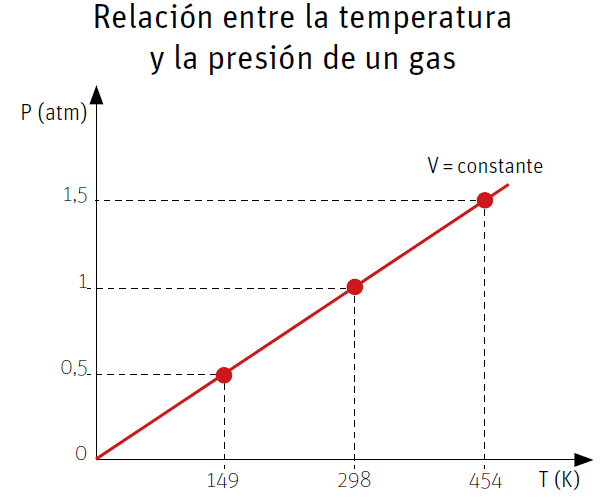
Por lo tanto, la ley de Gay-Lussac se puede expresar matemáticamente de la siguiente manera:

El cociente entre la presión inicial de un gas (P1), y su temperatura inicial (T1), tiene el mismo valor que el cociente entre la presión final (P2) y la temperatura final (T2) de este mismo gas. Lo anterior se puede expresar mediante la siguiente relación matemática:

Para facilitar el calculo, entregare el despeje de cada una de las variables.
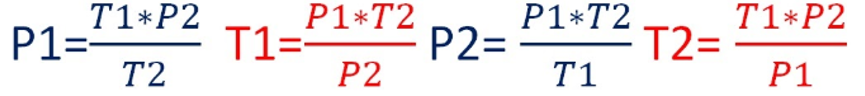
Video Resumen Ley de Gay-Lussac
La ley de Gay-Lussac solo se cumple cuando la temperatura es expresada en la escala kelvin. Para transformar la temperatura de grados Celsius (°C) a kelvin (K), se utiliza la siguiente ecuación:
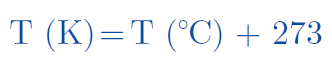
El siguiente video te enseñara a transformar la temperatura desde la unidad de grados Celsius a la unidad de temperatura de kelvin
A continuación se presentan un par ejemplos para calcular las distintas variables según la Ley de Gay-Lussac
ejemplo 1:
ejemplo 2
Obra publicada con Licencia Creative Commons Reconocimiento Compartir igual 4.0